研究紹介
研究のねらい
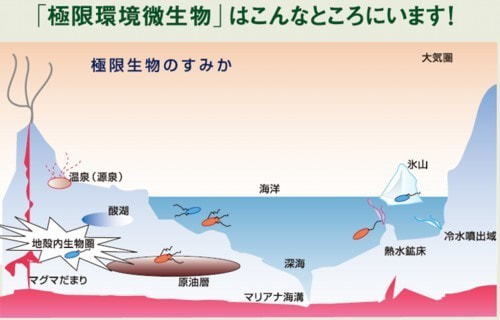
私たちの研究室が研究対象にしている生物は、極限環境微生物といって私たち人間がとても生活できないような過酷な環境を好んで生息しています(上図)。
その中でも高アルカリ性環境を好んで生育する微生物(好アルカリ性細菌)が持っている“特殊な能力”を解明し、社会に役立てる研究を推進しています。好アルカリ性細菌が生産する酵素やそこから作り出される産物は、私たちの社会の中で役立っています。詳しくは、 講談社ブルーバックスWebに記事を書いていますので是非お読みください。
その中でも高アルカリ性環境を好んで生育する微生物(好アルカリ性細菌)が持っている“特殊な能力”を解明し、社会に役立てる研究を推進しています。好アルカリ性細菌が生産する酵素やそこから作り出される産物は、私たちの社会の中で役立っています。詳しくは、 講談社ブルーバックスWebに記事を書いていますので是非お読みください。
1)Mrp(マープ)型Na+/H+アンチポーターを標的とする新規黄色ブドウ球菌生育阻害剤の探索
(キーワード:黄色ブドウ球菌、創薬ターゲット、Na+/H+アンチポーター、阻害剤探索)
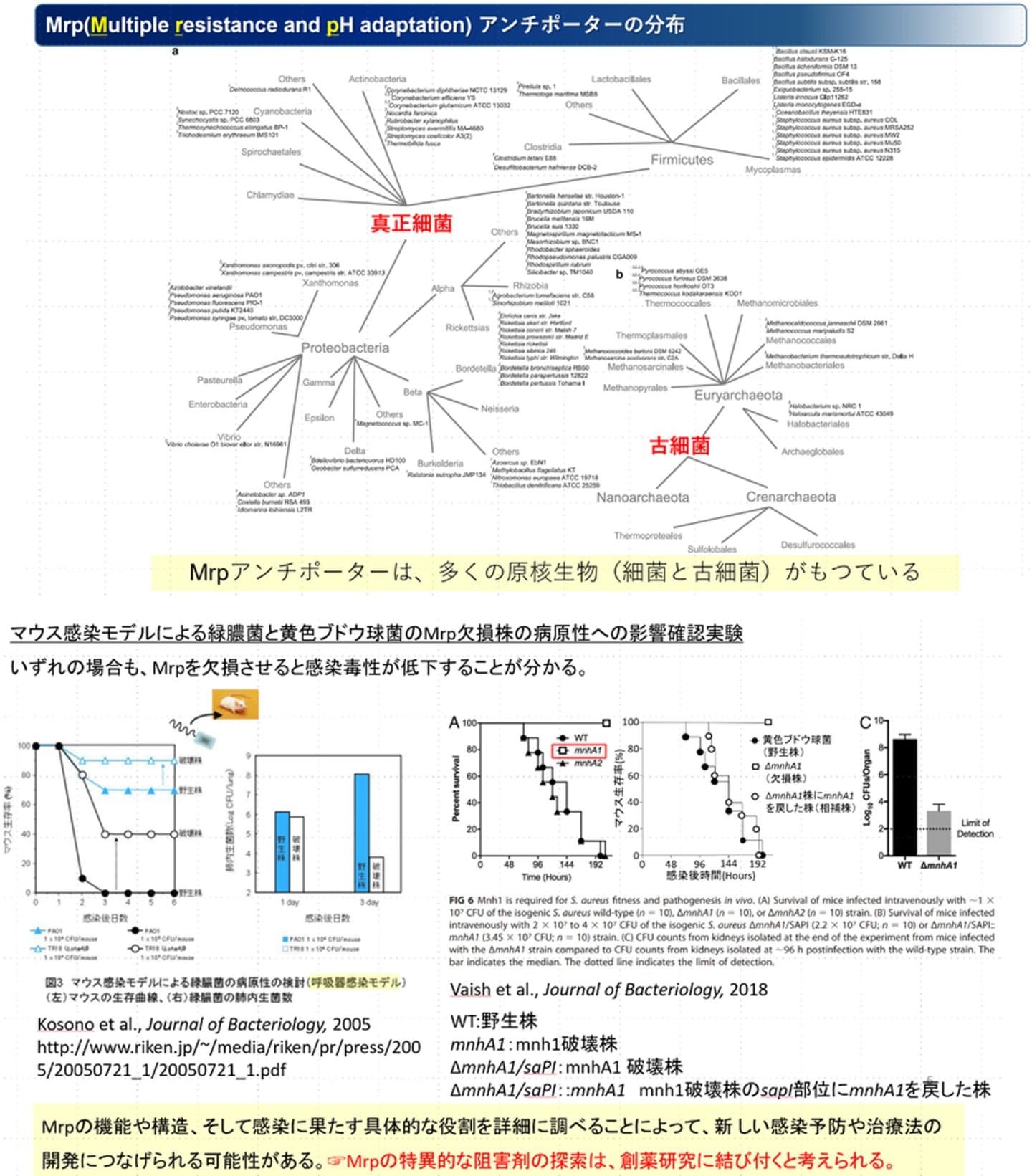
本研究の研究対象であるMrp型Na+/H+アンチポーターは、多くの微生物に普遍的に存在します[1,2]。また、細菌感染症を引き起こす黄色ブドウ球菌や緑膿菌では、mrp欠損株がマウスへの感染率と病原性の低下を引き起こすことが報告されています[3,4]。このようにMrpは、感染症や多剤耐性菌予防の有望なターゲットタンパク質として期待されています。私達の研究室では、これまで黄色ブドウ球菌や好アルカリ性Bacillus属細菌由来のMrpの機能解析を行ってきました。そこで、低分子化合物ライブラリーを活用して創薬研究にも直結する黄色ブドウ球菌由来のMrpに特異的な阻害剤の探索を行っています。[1] Swartz et al., Extremophiles, 9, 345–354 (2005)
[2] Ito et al., Frontiers in Microbiology, 8, e2325 (2017)
[3] Kosono et al., Journal of Bacteriology, 187, 5242–5248 (2005)
[4] Vaish et al., Journal of Bacteriology, 200, e00611-17 (2018)
2)好アルカリ性細菌Microbacterium sp. TS-1株のセシウム耐性機構の解明と応用
(キーワード:Cs+耐性、生物資材によるセシウムイオン回収技術の確立、好アルカリ性細菌)
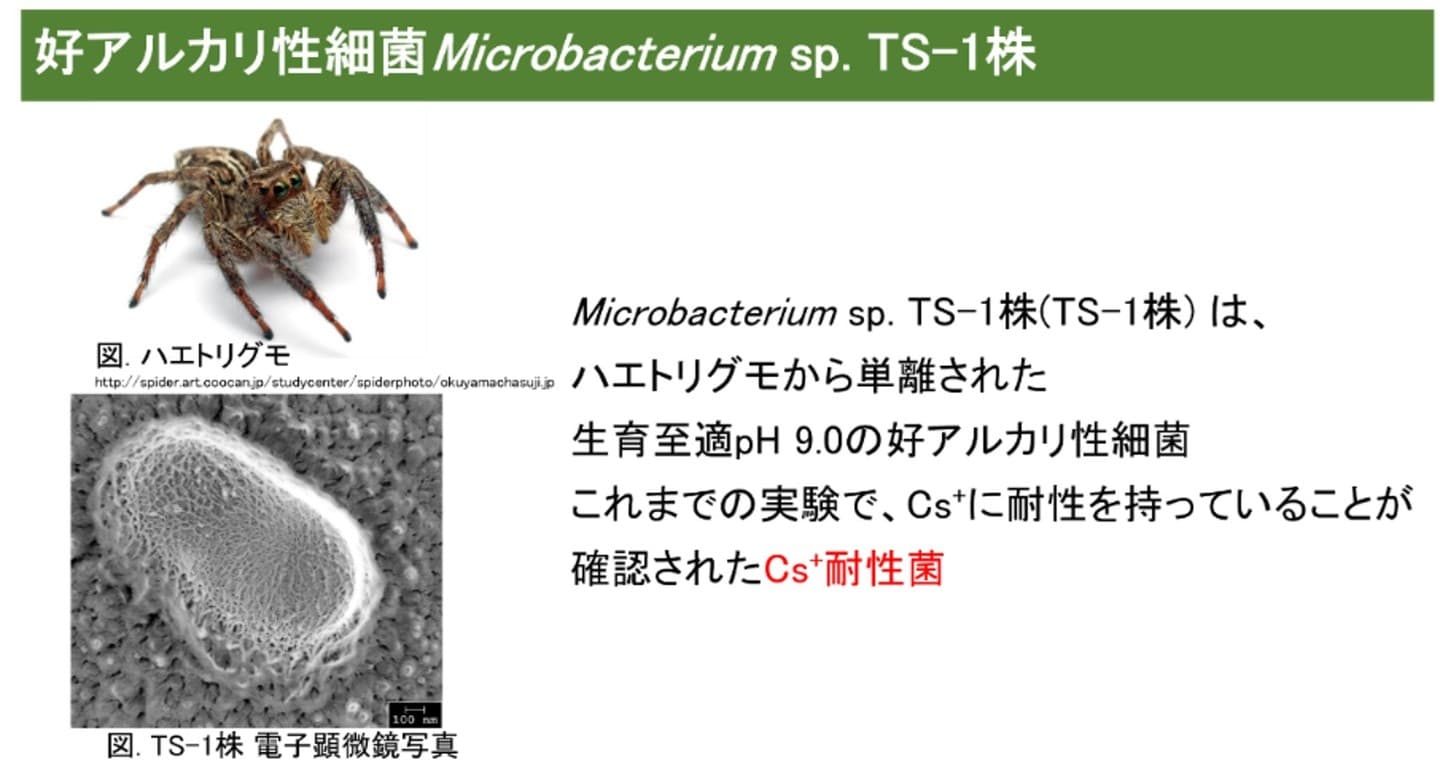
セシウム( Cs )はアルカリ金属の一種で、同位体( Cs134 、 Cs137 )は放射性核種であり、特に Cs137 は放射能汚染の主要な原因として問題視されています [1] 。一般的に Cs+ の物理的および化学的性質は K+ に類似しています [2] 。そのため、 Cs+ は K+ 輸送系を通して細菌の細胞内に取り込まれます。大腸菌では細胞内に取り込まれた Cs+ が排出されず、 K+ の排出が進み、細胞内での K+ 濃度の減少が起こることが知られています [3] 。 K+ は細胞内でタンパク質や核酸の合成やリボソームの安定化に寄与しているため、不足することで生育に阻害が生じます [4] 。私たちの研究室では、 2013 年にハエトリグモを擦潰したサンプルから好アルカリ性細菌 Microbacterium sp. TS-1 株 (TS-1 株 ) を単離し、そのゲノム配列を報告しました [5] 。この菌の生育至適 pH は 9.0 であり、大腸菌などが生育阻害を示す 0.4 M CsCl を含む培地で良好な生育を示し、 1.2 M CsClを含む培地でも生育する高濃度セシウムイオン耐性細菌 であることがわかりました。これまで報告されている高濃度 Cs+ 耐性菌の CsCl に対する生育上限濃度は、 Yersinia sp. Cs67-2 株の 0.5 M CsCl が最高 [6] であったことから、 TS-1 株は Cs+ に対して新規性が高く特殊な耐性機構を保持していると考えられます。
本研究テーマでは、 TS-1 株の Cs+ 耐性機構を明らかにし、ここで得られた新規な遺伝子資源を利用して高効率なセシウムイオン回収技術を開発することを目指しています。
[1] Buesseler O. K et al, (2012) PNAS 109, 5984-5988
[2] Avery S. V et al (1995) J. Ind. Microbiol. 14, 76-84
[3] Jung K et al (2001) J. Bacteriol. 183, 3800-3803
[4] Bossemeyer et al, (1989) J. Bacteriol. 171, 2219-2221
[5] Fujinami et al, (2013) Genome Announc. 1: e01043-13[6] Avery S. V. et al (1995) Microbiology 14, 76–84
3) 共培養微生物におけるバイオフィルム形成や運動性向上の解明
(キーワード:共培養(シンビオシス)・バイオフィルム・遊泳加速)
自然界では微生物はバイオフィルム(Biofilm)と呼ばれる高次構造体を形成し存在しています。バイオフィルムには、食物の腐敗や院内感染の原因の1つなど、生命に有害な側面があります[1]。 病院などの医療現場では、注射針やカテーテルの内部にバイオフィルムが形成されていると、バイオフィルムを取り除くことが難しく、院内感染の原因となっています。 実際の医療現場では、ヒトの健康や微生物の耐性機構の観点から、殺菌剤や抗生物質などの化学薬品を使わないバイオフィルム除去法の開発が望まれています[2]。本研究テーマでは、細菌を意図的に混合して培養する共培養時における細菌の運動性変化およびバイオフィルム形成に着目して研究を行っています。本研究では同一の土壌サンプル中から分離されたMethylobacterium sp. ME121株(以後ME121株と記す)と、Kaistia sp. 32K株(以後32K株と記す)を使用しています。両菌株ともグラム陰性細菌であり、ME121株は単極べん毛を持ち、運動性がある。一方、32K株はべん毛を持たず、運動性はない。これまでの研究結果から、ME121株と32K株の共培養時とME121株のみの単独培養時を比較すると、共培養時の方がME121株の有意な運動性向上が観察されます。また、32K株を単独で培養し取得した32K株培養上清を用いてME121株の遊泳観察を行った場合でも、運動性の向上が観察されます。このことから、32K株培養上清にME121株の運動性向上因子(K因子と命名)が存在することが推察されました。そこで32K株培養上清中に存在するK因子の精製および同定を試みた結果、組成の約55%が中性糖から構成される多糖類であることが明らかになりました。以上のことから、ME121株の運動性向上には32K株の生産する菌対外多糖類(Extracellular polysaccharide, EPS)の可能性が示唆されています[3]。
EPSはバイオフィルムの主成分です。EPSと推定された運動性向上因子について研究することは、バイオフィルムの形成メカニズムの解明にも寄与することが期待されます。現在、ME121株の運動性向上機構の解明とME121株と32K株のバイオフィルム形成について研究を推進しています。
[1] Colagiorgi et al., Microorganisms (2016), 4, 4030022.
[2] Petrova OE and Sauer K, Curr Opin Microbiol (2016), 30, 67-78
[3] Usui Yet al., Biomolecules (2020), 10 (4), 618
|
1
|